КРУГЛИКОВ ИЛЬЯ Wellcomet GmbH (Карлсруэ, Германия)
ШЕРЕР ФИЛИПП Touchstone Diabetes Center, Departments of Internal Medicine and Cell Biology, University of Texas Southwestern Medical Center (Даллас, США)
Статья была впервые опубликована в журнале Aging 2016; 8(7). Перевод и публикация на русский язык с разрешения авторов и издателя. Печатается в сокращении.
Дермальные адипоциты (ДА), формирующие в коже особое депо, активно взаимодействуют с соседними клетками и подвергаются существенным фенотипическим изменениям, которые можно наблюдать как при хроно-, так и при фотостарении кожи. Так, в хронически фотоповрежденной коже происходит уменьшение структур ДА с прогрессивным замещением их объема фиброзной тканью. Предполагается, что в основе этого явления лежит трансформация адипоцитов в миофибробласты. Вовлеченность ДА в старение кожи косвенно подтверждается корреляцией между особенностями гипертрофического рубцевания и проявлением симптомов старения кожи у разных этнических групп. Все эти наблюдения дают основание рассматривать дермальные адипоциты как одну из перспективных мишеней для anti-age программ косметологического ухода за кожей.
Вступление
Старение кожи — непрерывный процесс, происходящий под действием как внутренних (генетические особенности, хронические заболевания), так и внешних (физических и химических) факторов. Видимый резульутат — совокупность клинических признаков старения — является следствие м целого ряда структурных и физиологических изменений в кожной ткани на разных уровнях.
Каждая клетка кожи в той или иной степени участвует в ее старении. В связи с возрастными изменениями чаще всего упоминают фибробласты — с годам их активность по производству компонентов межклеточного матрикса снижается, что, в совокупности с повышением ферментативной активности матриксных металлопротеиназ, приводит к истончению дермального слоя и изменению его биомеханических свойств (эластичности и упругости). Такие выраженные признаки старения кожи, как глубокие морщины, дряблость и сосудистый рисунок, во многом обусловлены ухудшением качества дермального матрикса. Сухость, шероховатость и поверхностные морщинки — это результат замедления клеточного обновления эпидермиса и процесса ороговения кератиноцитов. Появление пигментных пятен является отражением изменения активности меланоцитов.
Что же касается адипоцитов, то в контексте старения традиционно говорят разве что об атрофии подкожно-жировой клетчатки и накоплении висцерального жира. До недавнего времени считалось, что действию внешних факторов подкожный жир практически недоступен по причине глубокого залегания, и все его возрастные изменения связаны с генетическими особенностями. Действительно, если мы говорим об ультрафиолетовом (УФ) излучении, то даже длинноволновые УФ-А-лучи (320–400 нм), которые наиболее глубоко проникают в кожу, не доходят до границы дермы и подкожной клетчатки и не могут напрямую воздействовать на адипоциты. Это обстоятельство стало причиной исключения жировой ткани из списка ключевых игроков, принимающих участие в фотостарении. Однако результаты последних исследований свидетельствуют об обратном.
Дермальные адипоциты — от почти неизвестных клеток до важнейших игроков в физиологии кожи?
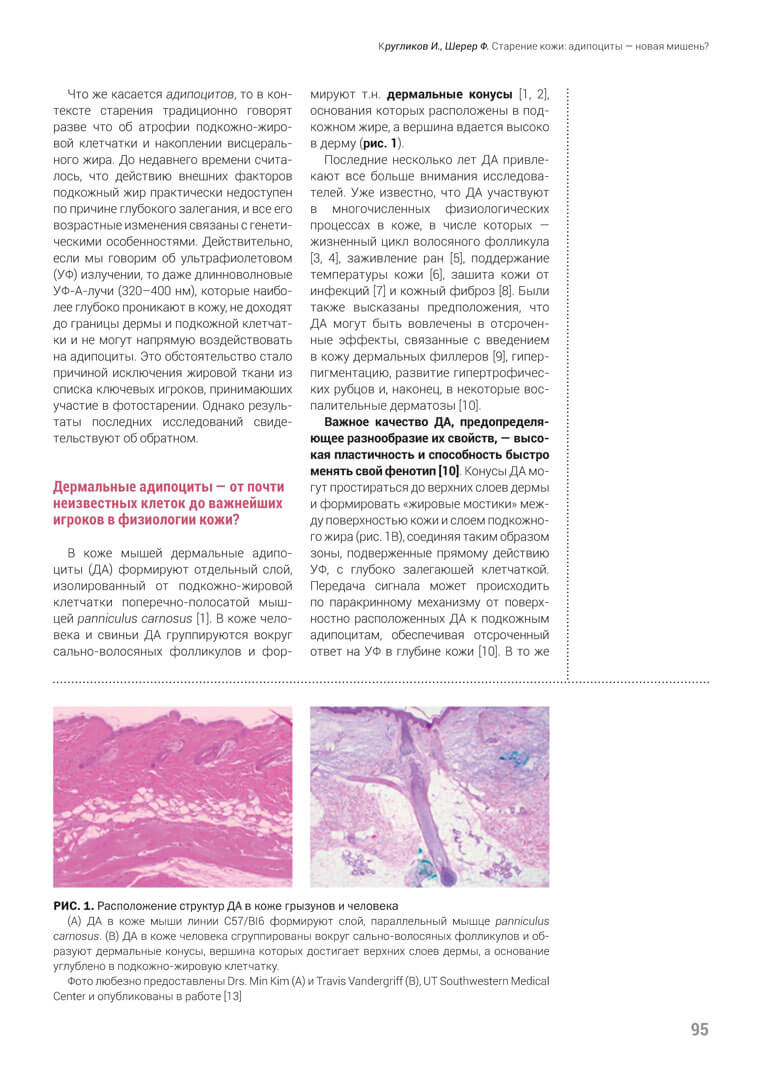
В коже мышей дермальные адипоциты (ДА) формируют отдельный слой, изолированный от подкожно-жировой клетчатки поперечно-полосатой мыш- цей panniculus carnosus [1]. В коже человека и свиньи ДА группируются вокруг сально-волосяных фолликулов и формируют т.н. дермальные конусы [1, 2], основания которых расположены в подкожном жире, а вершина вдается высоко в дерму (рис. 1).
Последние несколько лет ДА привлекают все больше внимания исследователей. Уже известно, что ДА участвуют в многочисленных физиологических процессах в коже, в числе которых — жизненный цикл волосяного фолликула [3, 4], заживление ран [5], поддержание температуры кожи [6], защита кожи от инфекций [7] и кожный фиброз [8]. Были также высказаны предположения, что ДА могут быть вовлечены в отсроченные эффекты, связанные с введением в кожу дермальных филлеров [9], гиперпигментацию, развитие гипертрофических рубцов и, наконец, в некоторые воспалительные дерматозы [10].
Важное качество ДА, предопределяющее разнообразие их свойств, — высокая пластичность и способность быстро менять свой фенотип [10]. Конусы ДА могут простираться до верхних слоев дермы и формировать «жировые мостики» между поверхностью кожи и слоем подкожного жира (рис. 1B), соединяя таким образом зоны, подверженные прямому действию УФ, с глубоко залегающей клетчаткой. Передача сигнала может происходить по паракринному механизму от поверхностно расположенных ДА к подкожным адипоцитам, обеспечивая отсроченный ответ на УФ в глубине кожи [10]. В то же время ДА гораздо быстрее, чем подкож- ные адипоциты, меняют свою структуру, благодаря чему они быстро адаптируются к внешним физическим воздействиям. Все эти особенности в совокупности дают возможность ДА одними из первых реагировать на УФ-облучение.
Эволюция дермальных адипоцитов при хроностарении
Возможности экспериментальных методов для исследования хроностарения in vivo довольно ограничены. Например, конфокальная микроскопия позволяет увидеть живой эпидермис и верхние слои дермы, но заглянуть в ретикуляр- ную дерму и подкожной жир уже не получится, поскольку глубина проникновения лазерного луча в кожу лимитирована. По этой причине мы сосредоточимся преимущественно на обсуждении старения кожи мышей, в которой ДА хорошо видны и их можно описать количественно.
Поскольку ДА проявляют половой диморфизм [11], для корректного сравнения должны браться животные одного пола.
Возрастная эволюция слоя ДА
К настоящему времени опубликовано довольно много статей, посвященных хронологическим возрастным изменениям слоя ДА в коже мышей.
В работе [12] эксперименты проводились на самках мышей линии BDF1 трех возрастных групп — молодые (6–10 нед), зрелые (13–19 нед) и старые (26–34 нед) особи. Помимо разделения по возрасту, животные были разделены на подгруппы в зависимости от стадии цикла волосяных фолликулов, поскольку состояние ДА зависит и от этого параметра1 [3]. Результаты исследования показали периодическую эволюцию слоя ДА: он присутствует у 6-недельных мышей (фаза анагена), сокращается у 9-недельных особей (фаза телогена), существенно возрастает у 12-недельных (анаген), снижается у 18-недельных (телоген) и очень сильно возрастает у 31-недельных мышей. Примечательно, что эволюционные изменения толщины слоя ДА коррелируют с жесткостью кожи, демонстрируя обратную зависимость — чем толще слой ДА, тем менее жесткая кожа.
Аналогичные изменения слоя ДА были показаны у мышей линии C57BL/6: толщина слоя ДА существенно возрастала у 12-недельных особей обоих полов [14]. Продолжительность жизни мышей C57BL/6, которые часто используются в экспериментах, в среднем составляет 29 мес у самцов и 26,5 мес у самок [15], так что эволюция слоя ДА между 2-м и 12-м месяцем жизни не может рассматриваться как проявление настоящего хроностарения.
Эволюция слоя ДА и генетика
Возрастные модификации ДА можно наблюдать на мышах разных линий, нокаутных по какому-то гену (т.е. имеющих мутацию, выключающую ген) и демонстрирующих ускоренное старение.
Так, 12-месячная мышь с делецией в гене, кодирующем каннабиоидный рецептор-1 (Cnr1–/–), стареет очень быстро и имеет редуцированный слой ДА в течение всей жизни.
Другая модель, удобная для изучения хроностарения кожи, — мыши линии PASG (с нуль-мутацией в гене proliferation associated SNF-2-like gene), также проявляют ускоренное старение, и в их коже практически отсутствует слой ДА [16].
У мышей с мутацией в гене p53 и ранним фенотипом старения в возрасте 24 мес (очень старые) структуры ДА практически отсутствуют, а у их диких собратьев этого же возраста слой ДА, хоть и уменьшенный, но есть [17].
У интактных мышей наблюдается хронологическая модуляция объема слоя ДА: вплоть до достижения зрелого возраста его объем то увеличивается, то сокращается. А в старости происходит инволюция, которая и может рассматриваться как признак настоящего хроностарения.
Влияние УФ на метаболизм подкожных адипоцитов
Несмотря на то что УФ-излучение практически не проникает до жировой клетчатки, оно тем не менее влияет на метаболизм подкожных адипоцитов. Мы можем это наблюдать не только в коже человека, подверженной хронической инсоляции, но и после однократного УФ-облучения неповрежденной кожи. Вот некоторые экспериментально подтвержденные факты.
Содержание свободных жирных кислот и триглицеридов в подкожных адипоцитах кожи предплечья, подверженной инсоляции, существенно ниже, чем в коже ягодиц, защищенной от света, у одного и того же человека. В то же время в молодой коже такой разницы нет, и это говорит о том, что на метаболизм адипоцитов влияет именно УФ, а не региональные вариации в метаболизме [18].
Как хроническое, так и однократное УФ-облучение снижает активность адипогенных мастер-факторов, таких как proliferator-activated receptor γ (PPARγ)2. Данный эффект проявляется быстро и продолжается по меньшей мере 72 ч после острого УФ-облучения. В качестве объяснения авторы работы [18] предположили, что некоторые растворимые факторы (такие, как IL-6, IL-8, MCP-3 и PIGF) вырабатываются в сосочковой дерме во время УФ-облучения и диффундируют в подкожную клетчатку, где запускают изменения метаболизма подкожных адипоцитов. Эта гипотеза подкрепляется тем фактом, что обработка подкожных адипоцитов цитокинами приводит к уменьшению содержания в них триглицеридов.
Список цитокинов, которые могут быть вовлечены в сигнальную передачу от поверхности кожи к подкожным адипоцитам, приведен в работе [19]. В ней было показано, что инкубирование преадипоцитов в кондиционированной среде, полученной от УФ-облученного эпидермального эквивалента и содержащей воспалительные цитокины IL-1α, IL-6, IL- 11 и TNF-α, ингибирует дифференцировку преадипоцитов в зрелые адипоциты.
В то же время введение в среду антител, нейтрализующих цитокины, существенно снижает негативное влияние цитокинов на дифференцировку. Это дает основание предположить, что воспалительные цитокины вовлечены в фотоиндуцированную инволюцию подкожного жира.
Однократное низкодозовое (1,6 Дж/см2) УФВ-облучение безволосых мышей линии Hos:HR-1 вызывает ряд изменений в организме уже в течение суток [20]. Во-первых, снижается уровень адипонектина3 в сыворотке крови и даже в периовариальной жировой ткани. Во-вторых, снижается уровень PPARγ в периовариальной жировой ткани. В-третьих, повышается уровень сывороточного белка амилоида А, который считается маркером воспаления. Из полученных результатов авторы делают вывод, что эффект УФ-В-излучения на удаленное от поверхности кожи депо адипоцитов опосредуется системными эндокринными механизмами.
Во всех описанных выше экспериментах был сделан вывод: мишени для УФ есть и в эпидермисе, и в дерме, а наблюдаемая реакция со стороны жировой ткани — результат непрямого воздействия, опосредованный сигналами от вышележащих мишеней.
В отличие от мышей, у которых депо ДА отделено от подкожного жира мышцей, в коже человека эти два пула адипоцитов — дермальный и подкожный — связаны между собой. Вершины дермальных конусов, достигающие сосочковой дермы (рис. 1B), могут напрямую получать дозу ультрафиолета и реагировать продукцией медиаторов, которые будут передавать сигнал нижележащим адипоцитам. Если это так, то между развитием признаков внешнего старения кожи человека и состоянием дермальных конусов есть корреляция.
Связь различных патологических процессов в коже с ДА не так уж необычна и описана, в частности, для гипертрофического рубцевания [21], которое происходит преимущественно в зонах с большим количеством дермальных конусов. Чтобы правильно оценить вклад ДА в фотостарение, мы должны выделить зоны, подверженные частому облучению, и зоны, защищенные от света. Наиболее облучаемые зоны, содержащие дермальные конусы, — щеки, шея, тыльная сторона кистей и предплечья. К защищенным зонам, имеющим дермальные конусы, относятся грудь, живот, ягодицы и бедра. Зоны, лишенные ДА, — ладони и волосистая часть головы [21].
Итак, что мы видим? Кисть руки: на тыльной стороне, где много ДА, выраженность признаков внешнего старения выше, чем на ладони, где ДА отсутствуют. Что касается признаков хроностарения, то их различия между тыльной и ладонной частью кисти не столь яркие. Какой из этого можно сделать вывод? УФ ускоряет процесс старения, но базовые механизмы старения зависят от некоторых других факторов, одним из которых может быть содержание ДА на конкретной области тела. Это обстоятельство делает старение кожи не только зависимым от участка, но и гетерогенным на одном и том же участке, поскольку частота расположения и размеры дермальных конусов могут варьировать [21]. Если это предположение верно, мы должны наблюдать мозаичную картину старения кожи.
Действие УФ на адипоциты in vitro
УФ-А-облучение стволовых клеток, выделенных из жировой ткани человека (СКЖТ), снижает их адипогенный дифференцировочный потенциал. Данный эффект связан с выраженным подавлением экспрессии PPARγ, вызванной УФА, и является дозозависимым — наблюдается уже при очень низких дозах (0,05 Дж/см2) и нарастает по мере увеличения дозы до 5,0 Дж/см2. Кроме того, в УФА-облученных адипоцитах ингибируется накопление триглицеридов [22].
Принимая во внимание, что низкодозовое УФ-А-излучение (0,05 Дж/см2) оказывает прямой эффект на СКЖТ, можно сделать вывод, что прямое действие УФ на дермальные адипоциты возможно, поскольку в коже они расположены в пределах досягаемости УФ.
Позже та же группа продемонстрировала, что УФ-А в сходных дозах поддерживает состояние «стволовости» СКЖТ, т.е. предотвращает вступление стволовой клетки на путь дифференцировки [23].
Итак, адипоциты могут отвечать даже на низкие дозы УФ подавлением экспресии PPARγ и адипоцитарной дифференцировки, а также снижением накопления триглицеридов в зрелых адипоцитах. Эти данные подкрепляют гипотезу, что не только системные пути, но и прямой локальный ответ ДА может быть вовлечен в реакцию подкожной клетчатки на УФ.
УФ уменьшает пул ДА и провоцирует фиброзирование кожи
Хроническое (5 р/нед, 20 нед, 16,3 Дж/см2 за сессию) УФА-облучение кожи безволосых мышей вызывает некоторое утолщение эпидермиса, но не дермы [24]. Вместе с тем оно приводит к исчезновению ДА, фиброзированию, а также увеличению содержания гиалуроной кислоты в нижних слоях дермы по сравнению с необлученными контрольными животными. Поскольку оказалось возможным предотвратить кожный фиброз в этих условиях с помощью гидрокортизона, был сделан вывод, что изменения в коже вызваны УФ-индуцированным воспалением.
Схожие наблюдения описаны в работе [25], проведенной на 11- и 16-недельных самках мышей линии C57BL/6J, которые подвергались хроническому (3 р/нед, 2–8 нед, 24 Дж/см2 за сессию) воздействию УФ-А. Спустя 2–4 нед после облучения изменения в коже были незначительны, но после 8 нед отмечались явная редукция ДА и возросшая аккумуляция коллагеновых волокон. Количество нерастворимого коллагена в дермальном слое этих мышей было примерно на 37% выше, чем в необлученном контроле. В то же время общая толщина дермы у 8-недельных облученных мышей была почти такой же, как и у контрольных особей того же возраста. Исходя из этих данных, авторы предположили, что УФ может вызвать замещение слоя ДА фиброзной тканью.
Описанные выше результаты должны быть переосмыслены с учетом недавно открытой способности ДА превращаться в миофибробласт [8]. Эта трансформация является важнейшим патофизиологическим шагом в кожном фиброзе. В работе [8] она вызывалась подкожной инъекцией блеомицина. Позднее было показано, что резистин-подобная молекула α (RELMα/ FIZZ1) может запускать дедифференцировку ДА и одновременно индуцировать экспрессию α-гладкомышечного актина и коллагена I типа, означающую фенотипическую трансформацию адипоцита в миофибробласт [26].
Процесс трансформации адипоцита в миофибробласт носит универсальный характер и может быть спровоцирован различными физическими и химичес- кими факторами, в т.ч. УФ (рис. 2) [24, 25]. Сценарий, по которому разворачиваются события в этом случае, иной, нежели в случае блеомицина. К тому же для проявления реакции клеточность дермальных конусов (т.е. число клеток в них) должна быть высокой. Это коррелирует с наблюдениями, описанными в работе [12]: хроническое УФ-облучение может провоцировать кожный фиброз только при достаточно длительной экспозиции, чтобы мыши могли достичь периода зрелости, характеризующегося выраженным увеличением слоя ДА.
Замещение слоя ДА фиброзной тканью через трансформацию адипоцитов в миофибробласты должно привести к неоднородности структуры кожи. Кроме того, данный процесс, происходящий под действием внешних факторов, может ускорить естественную потерю эффективного объема кожи (подразумевая под ним общий объем дермы и ДА). Так это или нет, можно проверить с помощью недавно разработанной мышиной модели AdipoChaser [27], которая позволяет наблюдать за превращениями адипоцитов в ткани.
Данный феномен, по крайней мере в случае фотостарения, сдвигает фокус наших интересов от соединительной ткани в сторону ДА. Что же касается хроностарения, то мы не можем полностью исключить, что процесс трансформации ДА в миофибрбласты в него не вовлечен.
Роль витамина Е в ответе кожи на УФ
Реакция кожи зависит не только от длины волны УФ и дозы облучения, но и от состояния ее собственных фотозащитных систем. Наряду с меланином, поглощающим УФ-излучение, к фотопротекторам относятся антиоксиданты, — они препятствуют развитию окислительного стресса, который развивается в УФ-облученной коже. Один из важнейших антиоксидантов — жирорастворимый α-токоферол (витамин Е) — присутствует в различных липидных структурах (будь то кожное сало, межклеточные липидные пласты рогового слоя, клеточные мембраны или же жировые капли адипоцитов) и защищает липиды от перекисного окисления. В облученной коже уровень α-токоферола снижается и резистентность кожи к УФ падает, что усугубляет процесс ее старения.
В составе поверхностных липидных структур (гидролипидная мантия и роговой слой) α-токоферол появляется из секрета (себум), выделяемого сальными железами. Но на его долю приходится всего лишь 10% общего содержания α-токоферола в коже, остальные 90% депонируется в липидных каплях адипоцитов [28].
В адипоцитах α-токоферол не только защищает липиды от окисления — он может стимулировать экспрессию PPARγ в ходе липогенеза и дифференцировку адипоцитов [29]. По всей видимости, это непрямая стимуляция, реализующаяся через ингибирование антагонистов PPARγ [30]. Примечательно, что α-токоферол может индуцировать экспрессию адипонектина, обладающего адипогенетическим эффектом [31]. Все эти факты дают нам дополнительный линк к пониманию вовлеченности ДА в ответ кожи на УФ.
Метаболизм α-токоферола в жировых клеток происходит медленно — период полураспада составляет примерно 184 дня [32]. Неизвестно, может ли хроническое УФ спровоцировать ускоренное высвобождение α-токоферола из ДА. Но если это происходит на самом деле, то запасы α-токоферола в ДА истощатся, что приведет к снижению адипогенетического дифференцировочного потенциала клеток и уменьшению накопления в них триглицеридов. В противоположность этому, однократное УФ-воздействие может вызвать компенсаторное увеличение пула ДА, что обеспечит кожу достаточным количеством α-токоферола. Таким образом, реакция ДА на УФ сильно зависит от режима облучения.
Иммуномодуляторы влияют на адипогенез и ускоряют старение кожи
Один из наиболее интригующих феноменов в старении кожи — ускорение этого процесса при приеме некоторых лекарств, например, таких иммуномодуляторов, как циклоспорин А (ЦсA). Так, если хроническое УФ-В-облучение неэритемными дозами безволосых мышей линии Skh-1 приводит к образованию морщин к 6–7-й неделе, то на фоне одновременного приема ЦсА морщины появляются уже на 4-й неделе [33]. Вместе с тем у безволосых мышей линии HRS/J, облучаемых в том же режиме, морщины не появляются даже на 10-й неделе; их нет и на 7-й неделе сочетанного облучения и приема ЦсА.
Почему так происходит? Напомним, что структура слоя ДА и их физиологическая активность в коже мышей зависят от генетики и стадии цикла волосяного фолликула [3]. Чаще всего в экспериментах используются самки мышей линии C57BL/6J, а также самки безволосых мышей линий линий Skh-1, HRS/J и безволосых мышей-альбиносов. Для мышей C57BL/6J характерна циклическая эволюция ДА [19]. Мутация в гене hr, вызывающая облысение, приводит к нарушению цикла волосяного фолликула, а также формированию открытых комедонов и цист в нижних слоях дермы и подкожном слое [34, 35]. Cлой ДА имеется у мышей линий Skh-1 и HRS/J, но у мышей HRS/J наряду с этим наблюдается и атрофия тимуса [36].
ЦсА относится к группе иммуносупрессоров, влияющих на продукцию цитокинов и на адипогенез. Это лекарство специфически ингибирует кальциневрин — фактор транскрипции, регулирующий перемещение цитозольных компонентов ядерного фактора активированных Т-лимфоцитов (NFAT) в ядро [37]. Помимо важной роли в реализации иммунного ответа, NFAT вовлечен в процессы старения кожи [33] и дифференцировку преадипоцитов [38]. В самом деле, на фоне длительного применения имуносупрессоров размер и число адипоцитов снижается [39], и это обстоятельство позволяет предположить, что ЦсА ингибирует адипогенез через блокаду NFAT-пути.
У безволосых мышей с атрофией тимуса имеется дефицит функциональных Т-клеток, в т.ч. пула iNKTs, являющегося резидентом жировой ткани [40]. Неизвестно, какой уровень экспрессии NFAT в дермальных адипоцитах может считаться нормальным для атимусных мышей, но мы видим, что он отличается от того, что есть у диких мышей. Это приводит к нарушению дифференцировки дермальных адипоцитов и может быть одной из причин качественных отличий эффектов ЦсА на старение кожи генетически различных линий [33].
Половой диморфизм ДА и старение кожи
Структуры ДА мышей демонстрируют явный половой диморфизм: у самок слой ДА в разы толще, чем у самцов, но общая толщина кожи у интактных самцов выше [11]. Толщина слоя ДА значительно увеличивается и у самок, и у самцов после гонадэктомии и, напротив, сокращается при приеме дигидротестостерона, 17β-эстрадиола или дегидроэпидандростерона. Эти эффекты, вероятно, связаны со способностью андрогенов ингибировать дифференцировку стволовых клеток из преадипоцитов в адипциты [41].
У мышей половой диморфизм наблюдается и в характере реакции кожи на УФ: самцы отвечают на УФ-А не так интенсивно, как самки [42], что коррелирует с более тонким слоем ДА у необлученных самцов и со способностью УФ-А проникать в кожу до мышцы panniculus carnosus. Это снова говорит о том, что у мышей ДА вовлечены как минимум в процессы внешнего старения.
У человека половой диморфизм структур ДА не так сильно выражен, но гендерная разница, вероятно, все же есть. Возможно, в этом кроется одна из причин различия старения кожи женщин и мужчин, но чтобы сказать наверняка, необходимы дальнейшие исследования.
Реакция ДА на УФ-облучение в коже мышей: гистологические доказательства
Гиперпродукция активных форм кислорода (АФК) — один из первый ответов кожи на УФ. АФК обычно рассматривают как повреждающий фактор, провоцирующий развитие патологий и старения. Все это так, но есть и другая сторона — АФК участвуют в многих физиологических процессах, например, могут как стимулировать, так и ингибировать пролиферацию и дифференцировку стволовых клеток жировой ткани [43]. Так, высокие дозы УФ-В способны подавить пролиферацию СКЖТ, низкие дозы могут повысить выживаемость этих клеток и стимулировать производство различных факторов роста [44]. Следовательно, и дермальные, и подкожные адипоциты отвечают на УФ-облучение в дозозависимой двухфазной манере.
Толщина слоя ДА у грызунов быстро меняется в ответ на различные физические воздействия [10]. В работе [25] слой ДА у мышей линии C57BL/6J истончался после УФ-А-облучения (3 р/нед, 8 нед, 24 Дж/см2 за сессию). Сходные результаты описаны в работе [45], в которой 6-недельных самок мыши линии C57BL/6J подвергали облучению низкими дозами УФ-В (4 р/нед, 30 нед, постепенное увеличение дозы). Гистологическая картина кожи этих мышей показала существенное истончение слоя ДА наряду с утолщением дермы. В работе [46] слой ДА у безволосых мышей линии Skh- 1 уменьшился после УФ-В-облучения (3 р/нед, 10 нед, постепенное повышение дозы от 20 до 180 мДж/см2).
Иную картину наблюдали в экспериментах на безволосых мышах. Так, в работе [47] 6-недельную мышь безволосого альбиноса — облучали однократно низкой дозой УФ (275–380 нм, 200 мДж/см2), эквивалентной минимальной эритемной дозе для этих животных. Биопсия кожи, взятая через 72 ч после облучения, показала утолщение дермы и слоя ДА. Аналогичные результаты представлены в работе [48]: после УФ-облучения (274– 380 нм, 3 р/нед, 6 нед, минимальная эритемная доза) у 8-недельной безволосой мыши линии HR-1 возросли объем и клеточность слоя ДА.
Таким образом, налицо качественные отличия в модификации слоя ДА у мышей линии C57BL/6J, имеющих волосяной покров, и безволосых мышей. Но все же необходимо еще раз эти отличия проверить с учетом пространственной гетерогенности слоя ДА, описанной в работе [13].
Инфракрасное (ИК) излучение с длиной волны до 1 мм также способно индуцировать внешнее старение [49]. Этот свет проникает в кожу гораздо глубже, чем УФ, и может достичь верхних слоев подкожной клетчатки. В связи с этим интересно сравнить эффекты ИК- и УФ- облучения. В работе [50] самцы крысы линии Wistar облучались ИК-светом (1100–1800 нм) в дозе 40 Дж/см2. Гистология кожи показала резкое увеличение толщины слоя ДА спустя 7 дней после облучения и последующее постепенное снижение числа этих клеток к 180-му дню. Вместе с тем в течение всего периода наблюдения число ДА в облученной коже было существенно выше, нежели в контроле. Механизмы ИК и УФ на кожу должны быть различны, но оба типа светового излучения способны вызвать изменения в ДА.
Дополнительные корреляции между ДА и УФ
Возможная роль витамина D в модуляции слоя ДА под действием УФ
УФ-В-излучение стимулирует синтез витамина D в коже. С другой стороны, витамин D вовлечен в старение кожи: как при гипо-, так и при гипервитаминозе признаки старения появляются быстрее [51].
У мышей, нокаутных по гену рецептора к витамину D (VDR–/–), симптомы преждевременного старения, такие как морщины и истонченный слой ДА, появляются быстрее по сравнению с дикими мышами [52]. Интересно, что у мышей VDR–/– уровень экспрессии разобщающего белка 1 (UCP1) в подкожных адипоцитах выше, и это приводит к образованию бежевых адипоцитов, занимающих промежуточное место между белыми и бурыми, что коррелирует с потерей объема подкожного жира [53, 54]. Еще один интригующий момент: адипоциты экспрессируют рецептор к витамину D и автономно производят 1,25-дигидроксивитамин D3 [55], что позволяет предположить, что адипоциты принимают участие в продукции витамина D после облучения кожи УФ.
Слой ДА в коже мышей может быть уменьшен путем применения высоких доз 1,25-дигидроксивитамина D3; в то же время, при нормализации уровня витамина D, размеры слоя ДА возвращаются к исходным [56]. Этот эффект связан со способность 1,25-дигидроксивитамина D3 ингибировать дифференцировку мышиных преадипоцитов через супрессию PPARγ [57]. Данное обстоятельство отражает хорошо известный факт, что рецептор к витамину D и PPAR-сигнальный путь тесно связаны друг с другом [58]. У человека, напротив, и 25-гидроксивитамин D3, и 1,25-дигидроксивитамин D3 могут стимулировать дифференцировку преадипоцитов [59] и мезенхимальных клеток [60]. Такое разнонаправленное действие витамина D на преадипоциты человека и мыши до сих пор не имеет объяснения.
У нас нет пока прямых доказательств того, что ДА могут производить витамин D, особенно после УФ-облучения, но вероятность этого высока. Если это так, УФ-В может модулировать структуру слоя ДА косвенно через индукцию производства витамина D в коже.
Возможная роль гиалуроновой кислоты в модуляции слоя ДА
ГК присутствует во всех слоях кожи, в т.ч. и в подкожно-жировой клетчатке. Показано, что уменьшение содержания ГК снижает дифференцировку преадипоцитов в адипоциты в условиях in vitro, а также аккумуляцию абдоминального жира у мышей линии C57BL/6J [61].
Многочисленные инъекции гиалуронидазы приводят к существенной (35%) редукции жировой массы и уменьшению размеров адипоцитов у мышей этой линии. Возможно, это связано с массивной деградаций ГК под действием гиалуронидазы, поскольку низкомолекулярные фрагменты ГК ингибируют дифференцировку преадипоцитов [62]. Эффекты ГК на адипоциты были недавно суммированы в работе [63].
УФ влияет на уровень ГК во всей толщине кожи [64]. Низкие дозы УФ-В повышают синтез ГК в эпидермисе [65], хроническое УФ-облучение снижает уровень ГК в дерме, что связывают с подавлением активности гиалуронатсинтазы [66]. Подобное поведение ГК в коже коррелирует с наблюдением увеличения объема слоя ДА после низких одиночных доз УФ и истощения этого депо после хронического облучения.
Этнические различия старения кожи — ДА тоже участвуют?
Считается, что процессы хроностарения кожи у людей разных национальностей одинаковы, но у фотостарения есть особенности, которые традиционно объясняют различиями в уровне и распределении меланина. Что же касается ДА, то информации об этнических особенностях этих структур недостаточно, чтобы делать однозначные выводы. Можно высказывать лишь предположения, ориентируясь на косвенные данные.
Так, известно об этнических особенностях гипертрофического рубцевания — процесса, который коррелирует с числом дермальных конусов в коже [21]. Недавно было показано, что тяжесть гипертрофических рубцов в самом деле варьирует у разных национальностей [67]: наибольшую склонность к ним проявляют люди негроидной расы, затем монголоидной и только потом европеоидной. Плотность и активность сальных желез снижаются в той же последовательности [68]. А поскольку число дермальных конусов связано с сально-волосяными фолликулами, то можно предположить, что отличия в старении кожи людей разной расовой принадлежности могут быть обусловлены и этим эффектом.
Взаимодействия между фибробластами и адипоцитами на местном уровне
Изменения ДА в ходе хроно- и фотостарения могут влиять на функцию фибробластов и таким образом способствовать модификации дермальных структур.
Увеличенные в размере адипоциты подавляют активность фибробластов, в то же время небольшие адипоциты подобного действия не проявляют [69]. Повышение объема подкожного жира коррелирует с уменьшением содержания эластиновых волокон в дермальном слое [70]. Следовательно, не только хроно- или фотостарение, но и увеличение слоя прилегающей жировой ткани может индуцировать относительно быструю деградацию эластиновых волокон — процесса, который при обычных условиях занимает многие десятки лет [71].
Обсуждение
ДА вовлечены в различные процессы в коже — и физиологические, и патологические. Физиологические реакции (такие, как иммунный ответ на патогены, терморегуляция) в норме приводят к увеличению жировых депо, обусловленному как гипертрофией, так и гиперплазией ДА. Напротив, патологические процессы (в частности, кожный фиброз) коррелируют с инволюцией структур ДА.
В нескольких исследованиях было показано, что и подкожные, и дермальные адипоциты могут реагировать на УФ-облучение. В зависимости от глубины залегания ответ адипоцитов на УФ может быть прямым (если УФ достигает клеток) либо косвенным (например, через активацию паракринных сигналов, через путь, связанный с рецепторами к витамину D, через продукты деградации ГК). Видимые гистологические изменения в ДА после УФ-облучения подтверждают прямой эффект УФ на клетки, в то время как уменьшение количества триглицеридов в ДА и снижение уровня адипонектина в удаленных жировых депо подтверждают косвенный механизм.
Половой диморфизм ДА и этничес- кие особенности старения кожи дают дополнительные аргументы насчет вов- леченности ДА в старение кожи. Самки мышей имеют более толстый слой ДА и сильнее реагируют на УФ, чем самцы той же линии. С другой стороны, осо- бенности старения кожи людей разных национальностей коррелирует со склон- ностью к гипертрофическому рубцева- нию. Принимая во внимание известную зависимость гипертрофических рубцов от участка тела и локальные вариации числа дермальных конусов на единицу площади, мы предположили, что струк- туры ДА могут отличаться у разных эт- нических групп и быть одной из причин разной скорости появления симптомов старения кожи у людей разных нацио- нальностей. Но чтобы подтвердить или опровергнуть данное предположения, нужны специальные исследования.
УФ-облучение вызывает расщепление структур ДА с последующим постепенным замещением фиброзной тканью, и вполне вероятно, что в этот процесс вовлечена недавно открытая трансформация ади- поцитов в миофибробласты. В экспери- ментальных моделях такая трансформа- ция вызывается инъекцией блемицина, но не исключено, что при фотостарении про- исходит нечто подобное. Но чтобы одно- значно говорить о том, что ДА участвуют в фотостарении таким образом, нужны дополнительные доказательства.
Высказанное недавно предположение о вовлеченности адипогенеза в отсрочен- ные реакции на введение гиалуроновых филлеров в кожу [9] косвенно предпола- гает, что престимулция ДА высокомоле- кулярной ГК может улучшить результат процедуры. В свете этих наблюдений ДА могут стать эффективной мишенью как для монотерапии старения кожи, так и комбинированной стратегии профилак- тики и коррекции возрастных изменений.
Вывод
Имеются серьезные доказательства того, что трансформация адипоцитов в мезенхимальные клетки вносит боль- шой вклад в развитие кожного фиброза. Это может быть важной частью фотоста- рения, при котором сокращается как пул ДА, так и объем подкожного жира при за- мещении фибротическими структурами.
Поскольку хроностарение связано с прогрессивным уменьшением объема ДА, нельзя исключать, что переход ади- поцитов в миофибробласты участвует и в этом виде старения кожи. Если это так, то дермальные адипоциты могут рассматриваться как важная и перспек- тивная мишень для anti-age программ профилактики и коррекции старения кожи.
ЛИТЕРАТУРА
1. Driskell R.R., Jahoda C.A.B., Chuong C.M., Watt F.M., Horsley V. Defi ning dermal adipose tissue. Exp Dermatol 2014; 23: 629–631.
2. Wojciechowicz K., Gledhill K., Ambler C.A., Manning C.B., Jahoda C.A. Development of the mouse dermal adipose layer occurs independently of subcutaneous adipose tissue and is marked by restricted early
expression of FABP4. PloS One 2013; 8: 59811. 3. Festa E., Fretz J., Berry R., Schmidt B., Rodeheffer M., Horowitz M., Horsley V. Adipocyte lineage cells contribute to the skin stem cell niche to drive hair cycling. Cell. 2011; 146: 761–771.
4. Chen C.C., Plikus M.V., Tang P.C., Widelitz R.B., Chuong C.M. The modulatable stem cell niche: tissue interactions during hair and feather follicle regeneration. J Mol Biol 2016; 428(7): 1423–1440.
5. Schmidt B.A., Horsley V. Intradermal adipocytes mediate fi broblast recruitment during skin wound healing. Development 2013; 140: 1517–1527.
6. Alexander C.M., Kasza I., Yen C.E., Reeder S.B., Hernando D., Gallo R.L., Jahoda C.A.B., Horsley V., MacDougald O.A. Dermal white adipose tissue: a new component of the thermogenic response. J Lipid Res 2015; 56: 2061–2069.
7. Zhang L.J., Guerrero Juarez C.F., Hata T., Bapat S.P., Ramos R., Plikus M.V., Gallo R.L. Innate immunity. Dermal adipocytes protect against invasive Staphylococcus aureus skin infection. Sci 2015; 347: 67–71.
8. Marangoni R.G., Korman B.D., Wei J., Wood T.A., Graham L.V., Whitfi eld M.L., Scherer P.E., Tourtellotte W.G., Varga J. Myofi broblasts in murine cutaneous fi brosis originate from adiponectin-positive intradermal progenitors. Arthritis Rheumatol 2015; 67: 1062–1073.
9. Kruglikov I.L ., Wollina U. Soft tissue fi llers as non-specifi c modulators of adipogenesis: change of the paradigm? Exp Dermatol 2015; 24: 912–915.
10. Kruglikov I.L., Scherer P.E. Dermal adipocytes: from irrelevance to metabolic targets? Trends Endocrinol Metabol 2015; 27: 1–10.
11. Azzi L., El-Alfy M., Martel C., Labrie F. Gender differences in mouse skin morphology and specifi c effects of sex steroids and dehydroepiandrosterone. J Invest Dermatol 2005; 124: 22–27.
12. Wang Y., Marshall K., Baba Y., Gerling G.J., Lumpkin E.A. Hyperelastic material properties of mouse skin under compression. PloS One. 2013; 8: 67439.
13. Kruglikov I.L., Scherer P.E. Dermal adipocytes and hair cycling: Is spatial inhomogeneity a characteristic feature of the dermal adipose tissue depot? Exp Dermatol 2016; 25: 258–262.
14. Bilkei-Gorzo A., Drews E., Albayram Ö., Piyanova A., Gaffal E., Tueting T., Michel K., Mauer D., Maier W., Zimmer A. Early onset of aging-like changes is restricted to cognitive abilities and skin structure in Cnr1-/- mice. Neurobiol Aging. 2012; 33: 200.e11–200.e22.
15. Kunstyr I., Leuenberger H.G.W. Gerontological data on C57BL/6 mice. I. Sex differences in survival curves. J Gerontol 1975; 30: 157–162.
16. Sun L.Q., Lee D.W., Zhang Q., Xiao W., Raabe E.H., Meeker A., Miao D., Huso D.L., Arceci R.J. Growth retardation and premature aging phenotypes in mice with disruption of the SNF2-like gene, PASG. Gen Develop 2004; 18: 1035–1046.
17. Tyner S.D., Venkatachalam S., Choi J., Jones S., Ghebranious N., Igelmann H., Lu X., Soron G., Cooper B., Brayton C., Park S.H., Thompson T., Karsenty G., Bradley A., Donehower L.A. p53 mutant mice that display early ageing-associated phenotypes. Nat 2002; 415: 45–53.
18. Kim E.U., Kim Y.K., Kim J.E., Kim S., Kim M.K., Park C.H., Chung J.H. UVmodulation of subcutaneous fat metabolism. J Invest Dermatol 2011; 131: 1720–1726.
19. Li W.H., Pappas A., Zhang L., Ruvolo E., Cavender D. IL-11, IL-1α, IL-6, TNFα are induced by solar radiation in vitro and may be involved in facial subcutaneous fat loss in vivo. J Dermatol Sci 2013; 71: 58-66.
20. Matsui S., Yamane T., Kobayashi-Hattori K., Oishi J. Ultraviolet B irradiation reduces the expression of adiponectin in ovarial adipose tissues through endocrine actions of calcitonin gene-related peptide-induced serum amyloid A. PLoS One. 2014; 9: 98040.
21. Schmidt B.A., Horsley V. Intradermal adipocytes mediate fi broblast recruitment during skin wound healing. Develop 2013; 140: 1517–1527.
22. Lee J., Lee J., Jung E., Kim Y.S., Roh K., Jung K.H., Park D. Ultraviolet A regulates adipogenic differentiation of human adipose tissue-derived mesenchymal stem cells via upregulation of Kruppel-like factor 2. J Biol Chem 2010; 285: 32647–32656.
23. Lee J., Jung E., Hyun J.W., Park D. Ultraviolet A regulates the stemness of human adipose tissue-derived mesenchymal stem cells through downregulation of the HIF-1α via activation of PGE2–cAMP signaling. J Cell Biochem 2012; 113: 3681–3691.
24. Mitani H., Koshiishi I., Toyoda H., Toida T., Imanari T. Alterations of hairless mouse skin exposed to chronic UV irradiation and its prevention by hydrocortisone. Photochem Photobiol 1999; 69: 41–46.
25. Sayama A., Soushin T., Okada T., Doi K., Nakayama H. Morphological and biochemical changes during aging and photoaging of the skin of C57BL/6J mice. J Toxicol Pathol 2010; 23: 133–139.
26. Martins V., Gonzalez De Los Santos F., Wu Z., Capelozzi V., Phan S.H., Liu T. FIZZ1-Induced myofi broblast transdifferentiation from adipocytes and its potential role in dermal fi brosis and lipoatrophy. Am J Pathol 2015; 185: 2768–2776.
27. Wang Q.A., Scherer P.E. The adipochaser mouse: a model tracking adipogenesis in vivo. Adipocyte 2014; 3: 146–150.
28. Landrier J.F., Marcotorchino J., Tourniaire F. Lipophilic micronutrients and adipose tissue biology. Nutrients 2012; 4 :1622–1649.
29. Uto-Kondo H., Ohmori R., Kiyose C., Kishimoto Y., Saito H., Igarashi O., Kondo K. Tocotrienol suppresses adipocyte differentiation and Akt phosphorylation in 3T3-L1 preadipocytes. J Nutrit 2009; 139: 51–57.
30. Kawahara A., Haraguchi N., Tsuchiya H., Ikeda Y., Hama S., Kogure K. Peroxisome proliferator-activated receptor γ (PPARγ)-independent specifi c cytotoxicity against immature adipocytes induced by PPARγ antagonist T0070907. Biol Pharm Bull 2013; 36: 1428–1434.
31. Landrier J.F., Gouranton E., El Yazidi C., Malezet C., Balaguer P., Borel P., Amiot M.J. Adiponectin expression is induced by vitamin E via a peroxisome proliferator-activated receptor γ-dependent mechanism. Endocrinol 2009; 150: 5318–5325.
32. Novotny J.A., Fadel J.G., Holstege D.M., Furr H.C., Clifford A.J. This kinetic, bioavailability, and metabolism study of RRR-α-tocopherol in healthy adults suggests lower intake requirements than previous estimates. J Nutrition. 2012; 142: 2105–2111.
33. Moloney S.J., Learn D.B. The effect of systemic cyclosporine A on a hairless mouse model of photoaging. Photochem Photobiol 1992; 56: 495–504.